FSIP2是生精功能障碍34型的致病基因,有害变异会导致男性弱畸形精子症。虽然FSIP2变异对应的临床表型已经明确,但背后的致病机制还有待探索。今年1月份,安徽医科大学第一附属医院生殖医学中心贺小进、曹云霞团队和复旦大学附属妇产科医院张锋团队共同在International Journal of Biological Sciences(IF=10.750)上发表了一篇关于FSIP2基因突变导致男性不育的文章,题为“Novel FSIP2 Variants Induce Super-Length Mitochondrial Sheath and Asthenoteratozoospermia in Humans”。该研究报道了3名携带FSIP2复合杂合变异的弱畸形精子症患者,并对该基因背后的致病机制进行了深度探索。

摘要
弱畸形精子症是男性不育的重要因素之一,但仍有大量病例的致病原因并不明确。研究团队对105名弱畸形精子症患者进行了全外显子组测序,检出3名患者携带FSIP2基因突变,他们没有血缘关系。FSIP2的有害变异能够导致精子纤维鞘瓦解和鞭毛轴丝缺陷。该研究中患者精子呈现明显的“超长”线粒体鞘,线粒体鞘外膜蛋白TOMM20水平升高,线粒体ATP的消耗减少。同时观察到精子环的错位或缺失,环蛋白SEPT4减少或错位。3名患者中有2名的女性伴侣通过ICSI成功妊娠。总而言之,研究团队推断FSIP2不仅仅是纤维鞘的结构蛋白,同时也是鞭毛内部的运输者,参与了鞭毛轴丝的组装,线粒体的选择和精子发生过程中线粒体鞘延伸的终止,ICSI是治疗FSIP2基因突变相关弱畸形精子症患者的有效方法。
背景介绍
目前,大约有1/6的育龄夫妇深受不孕不育之苦,男性因素占比约50%。少精症、弱精症和畸形精子症是精子异常的主要原因,其中弱畸形精子症最为常见。弱畸形精子症主要表现为精子运动能力下降和精子形态学异常,占男性不育的19%。
畸形精子是指精子存在头、颈、尾的形态学异常,可能导致精子运动能力下降。精子尾部异常包括鞭毛缺失、短、弯曲、盘绕或者不整齐。鞭毛轴丝是一种进化上保守的活动纤毛和精子鞭毛结构,内部呈独特的9+2微管排列方式,即外周有9对对称排列的微管双联体(DMT,double-microtubules),其间由动力蛋白相互连接,双联体与2对中央微管(CP,central pairs )连接。鞭毛轴丝及轴丝周围、转运蛋白或中心体组装出现问题均会导致精子尾部异常,从而表现为弱畸形精子症。例如,轴丝动力蛋白重链(DNAH)家族和鞭毛/纤毛相关蛋白(CFAP)的相关基因发生有害变异会导致鞭毛轴丝结构异常。此外,TTC21A(MIM: 618429),TTC29(MIM: 618735)和CFAP69(MIM: 617949)基因变异能通过精子发生时的运输途径严重破坏鞭毛轴丝的组装,包括鞭毛内运输(IFT,intra-flagellar transport )和精子领内运输(IMT,intra-manchette transport )。还有,DZIP1(MIM: 608671)和CEP135的双等位基因变异会使中心粒组装异常,从而导致男性不育。尽管如此,还有很多导致弱畸形精子症的基因是未知的。
纤维鞘(FS,fibrous sheath )是精子尾部发育过程中鞭毛轴丝启动后形成的第一个附属结构,主要由A型激酶锚定蛋白(AKAPs,A-kinase anchoring proteins )组成,包括AKAP3, AKAP4和AKAP14。AKAP3和AKAP4基因突变会导致纤维鞘发育不良。纤维鞘相互作用蛋白2(FSIP2,Fibrous sheath-interacting protein 2)位于纤维鞘中,并直接与AKAP14相互作用。FSIP2的变异导致中央微管缺失和鞭毛轴丝缺陷,表现为精子鞭毛多发形态异常( multiple morphological abnormalities of the sperm flagella, MMAF)。
线粒体鞘(MS,mitochondrial sheath)螺旋排列在精子鞭毛中部,为精子鞭毛运动提供能量。在人类精子中,线粒体鞘中72-80个细长的线粒体行成了10-12个螺旋。小鼠实验研究发现,Fsip1-/-小鼠精子表现出线粒体异常积累。在人类中,精子异常包括中间段变短和线粒体循环减少,线粒体组装异常,以及线粒体膜的结构缺陷,这些均与弱精子症有关。
本次研究在3个无血缘关系的弱畸形精子症患者中检测到FSIP2基因变异,该变异导致纤维鞘严重解体和鞭毛轴丝缺损。患者精子表现出“超长”的线粒体鞘,线粒体ATP消耗减少,环蛋白SEPT4减少或错位。此外,这3名男性中有2名的女性伴侣在经ICSI治疗后成功妊娠,说明ICSI是治疗此类疾病的有效方法。
研究方法
通过对105名弱畸形精子症患者队列进行全外显子组测序(WES),研究团队发现了3个无血缘关系的个体携带FSIP2基因变异。
研究团队对患者进行了精子活力和精子形态检测,对患者的精子进行了扫描电镜(SEM)和透射电镜(TEM)分析,并加以正常对照。
为明确FSIP2 的背后致病机制,研究者除了检测FSIP2在患者精子中的表达量变化,还做了线粒体鞘外膜蛋白TOMM20、环蛋白SEPT4以及IFT相关蛋白的表达水平和定位分析,用到的检测方法有:RT-qPCR、荧光免疫分析和蛋白质印迹法(WB)。
此外,采用了CellTiter-Glo荧光细胞活力法检测精子ATP含量,通过流式细胞仪检测染色后的精子以分析线粒体膜电位(MMP)。
最后,对这些患者的ICSI结局进行了追踪与记录。
研究结果
在3名弱畸形精子症患者上确定FSIP2致病性变异
此次研究中,通过WES在3名弱畸形精子症患者上发现了FSIP2的复合杂合变异,并通过了一代测序验证。这3名患者无血缘关系,他们编号分别为P1、P2、P3,其变异位点和家系图如图1A所示。FSIP2蛋白是鞭毛纤维鞘的重要组成部分,它包含了3个FSIP2区域和一个螺旋结构域。6个变异位点所在基因外显子和蛋白产物的位置如图1B所示,变异信息如表1所示。
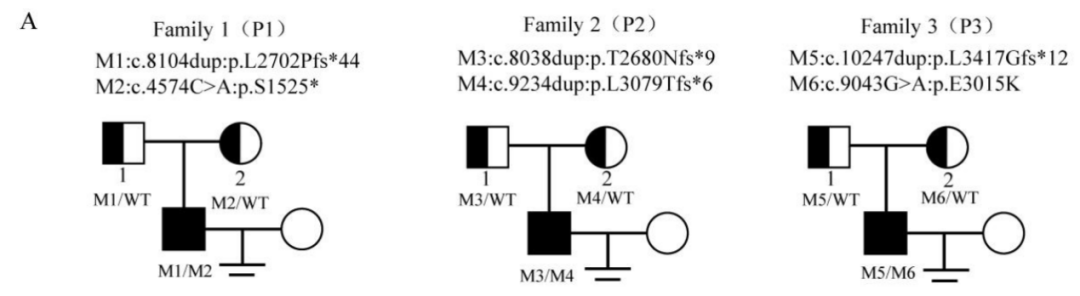
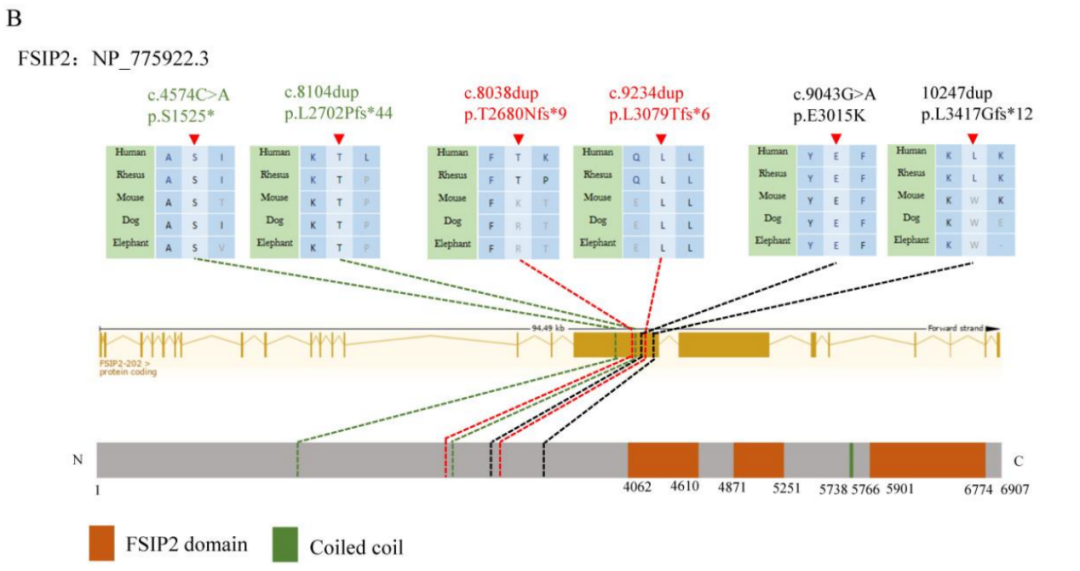
图1 三个家系中导致弱畸形精子症的FSIP2基因变异
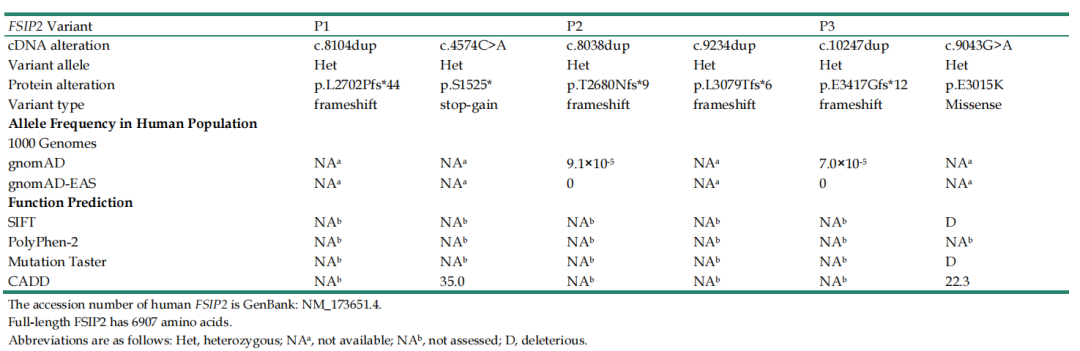
表1 所检出的3名患者的变异位点信息
FSIP2变异与精子超长线粒体鞘及精子中段变粗有关
精液参数参考WHO第六版标准,这些患者的精液体积与浓度均正常,但精子活力较低,详细参数如表2所示。
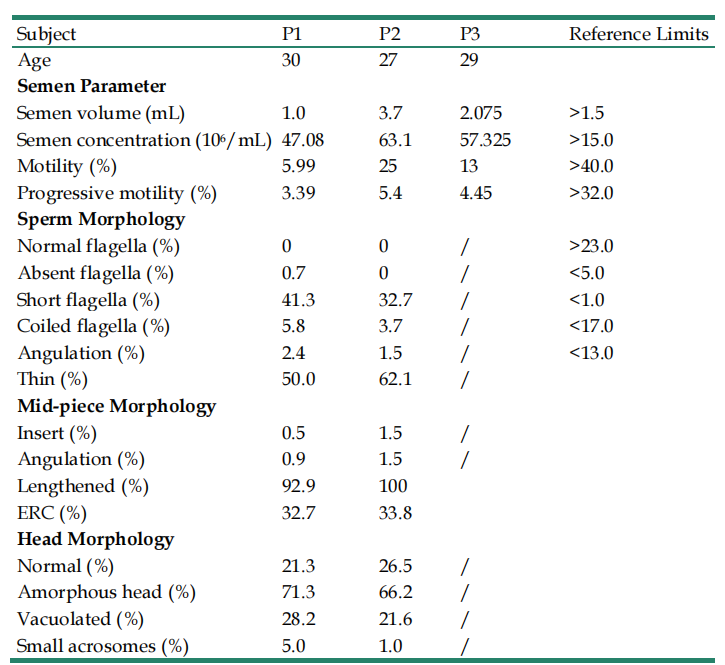
表2 携带FSIP2 变异的3名患者的精液参数
患者精子细胞的形态学通过HE和巴氏染色进行评测。通过观察,发现患者大部分精子形态呈现出细长的中段连接着或短或薄的主段,主段周围存在发育不良的纤维鞘,或者完全没有纤维鞘,如图2A所示,精子形态学参数见表2。电镜结果显示,与对照组相比,携带FSIP2变异的患者精子颈部较粗,线粒体鞘中部较长,精子主段发育不良,如图2B所示。使用透射电镜观察精子鞭毛的纵向切片显示,与正常对照相比,携带患者精子的线粒体鞘长度是正常对照的两倍多。此外,与正常精子中排列规则的线粒体鞘和由环空连接的纤维鞘相比,携带FSIP2变异的患者缺少精子环,表现出严重的纤维鞘发育不良,如图2C和2D所示。以上结果表明FSIP2变异不仅会影响纤维鞘的组装,也会导致线粒体鞘的延长。
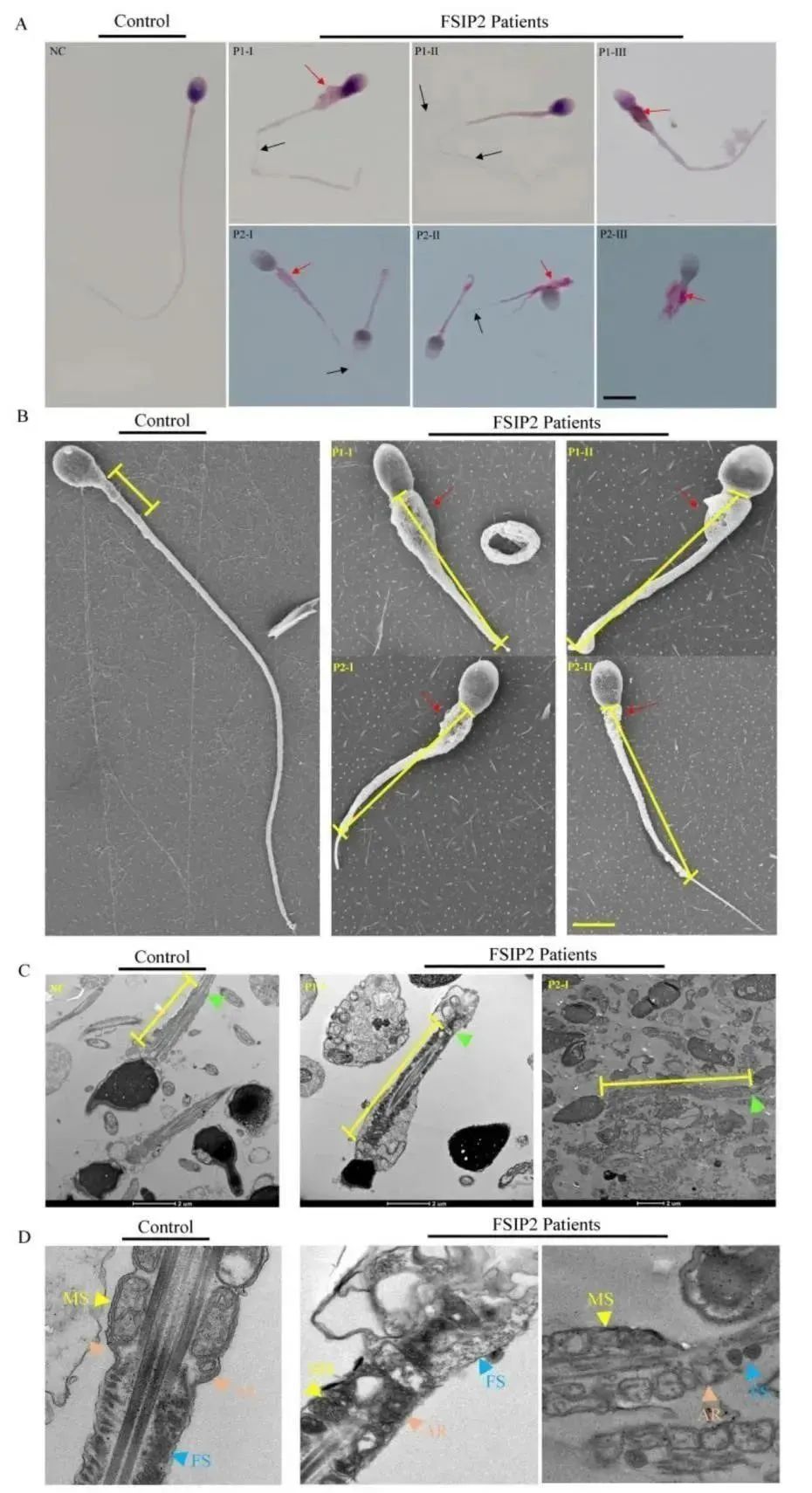
图2 患者和正常对照精子的形态和超微结构对比
FSIP2变异导致鞭毛轴丝和纤维鞘结构严重瓦解
透射电子显微镜法用于评估患者精子鞭毛的超微结构。P1中有24%的鞭毛中部缺失中央微管, P2中有21%的鞭毛中部缺失中央微管,如图3A和3C所示。电镜下正常的精子主段中,鞭毛轴丝被7个外层致密纤维环绕,侧面有纤维鞘,第3号和8号外层致密纤维被纵向柱列所取代。在患者中,36%和43%的横截面有紊乱的纤维鞘围绕着鞭毛轴丝;34%和31%的横截面缺少鞭毛轴丝和外层致密纤维,其它部分则是不规则的鞭毛轴丝和外层致密纤维。另外,在一些主段中也有9个外层致密纤维全部被观察到的,说明纵向柱列没有取代3号和8号致密纤维,如图3B和3D所示。
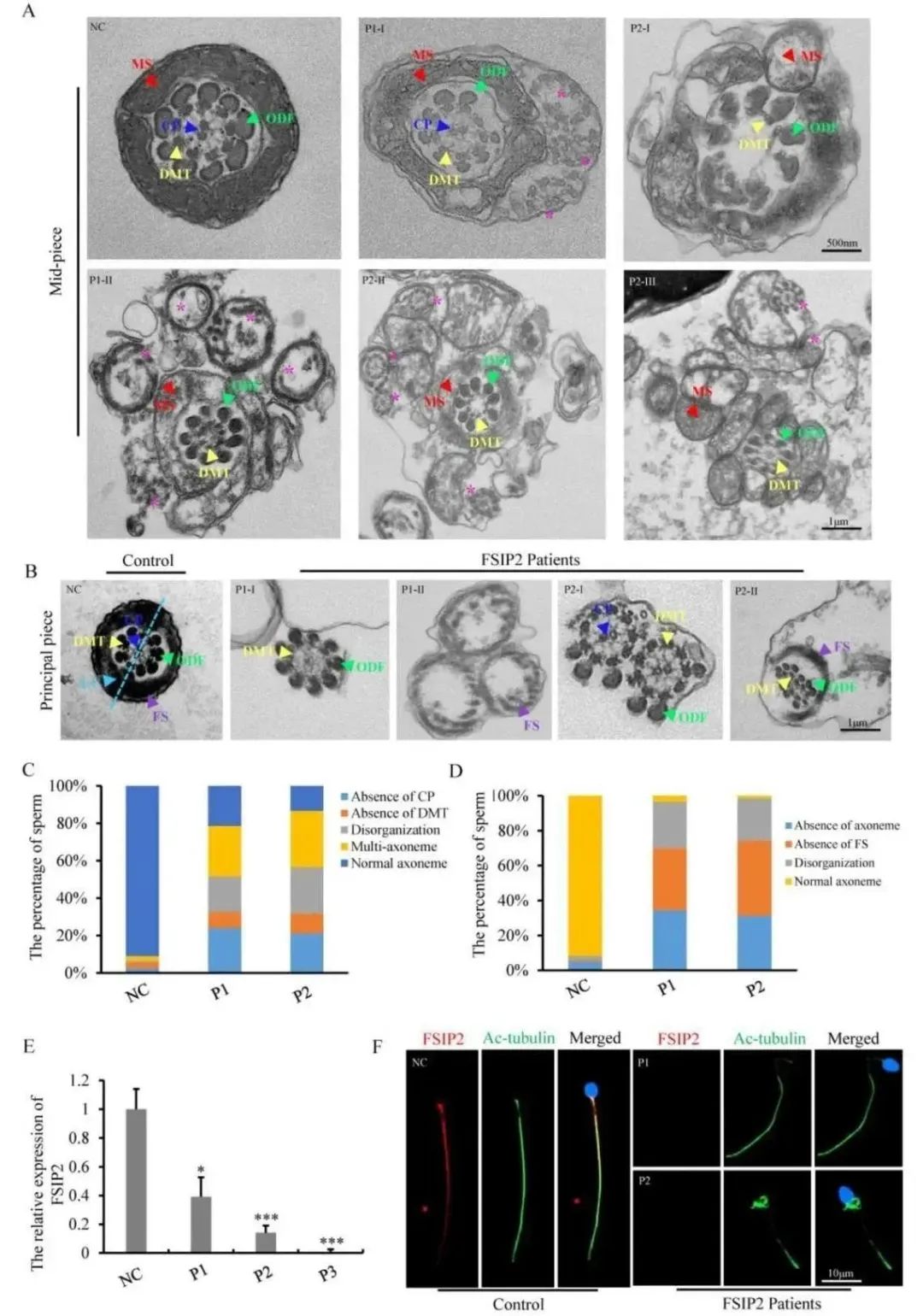
图3 FSIP2缺陷与精子鞭毛轴丝畸形和中心对缺失相关
FSIP2仅在人类和小鼠的睾丸中表达,为明确表达量变化,研究者利用RT-qPCR和免疫荧光技术检测了FSIP2在精子细胞中的表达和定位,样本分为正常对照组和FSIP2患者组,RT-qPCR结果显示患者组的FSIP2表达量明显降低,如图3E所示。免疫荧光检测结果显示,正常精子细胞鞭毛中的FSIP2染色信号较强,而患者组的精子中FSIP2的信号几乎不可见,如图3F所示。
FSIP2变异与线粒体蛋白增加,ATP消耗降低和环状物异位有关
前面实验结果可以说明FSIP2在线粒体鞘组装与精子鞭毛形成中作用重大,为研究FSIP2变异对线粒体鞘组装状态的影响,研究者又评估了线粒体外膜蛋白TOMM20的表达水平。在正常精子中,TOMM20染色信号集中在中段外,长度约为5 μm,与精子头部长度大致相同。与之相比,患者组中的信号长度是对照组的2-3倍,P1和P2分别为13.04±3.71 μm和14.20±3.99 μm,如图4A,B和C所示。为了确定线粒体鞘的延长是FSIP2变异所致,而非MMAF的表型所致,研究者获取了先前报道的FSIP2变异的弱畸形精子症患者的精液样本(编号A011),以及携带 DNAH10和TTC21A基因变异的MMAF患者的精液样本,进行了TOMM20免疫荧光检测。AO11的结果也显示线粒体鞘明显延长,如图4A,B和C所示,而DNAH10和TTC21A样本的结果则与正常对照组相似。同时,WB染色显示P1和P2的TOMM20蛋白水平是正常对照组的1-2倍,如图4D和E所示。另外,乙酰化微管蛋白荧光显示,携带FSIP2变异的患者的许多精子中观察到鞭毛轴丝畸形,如图4A所示。
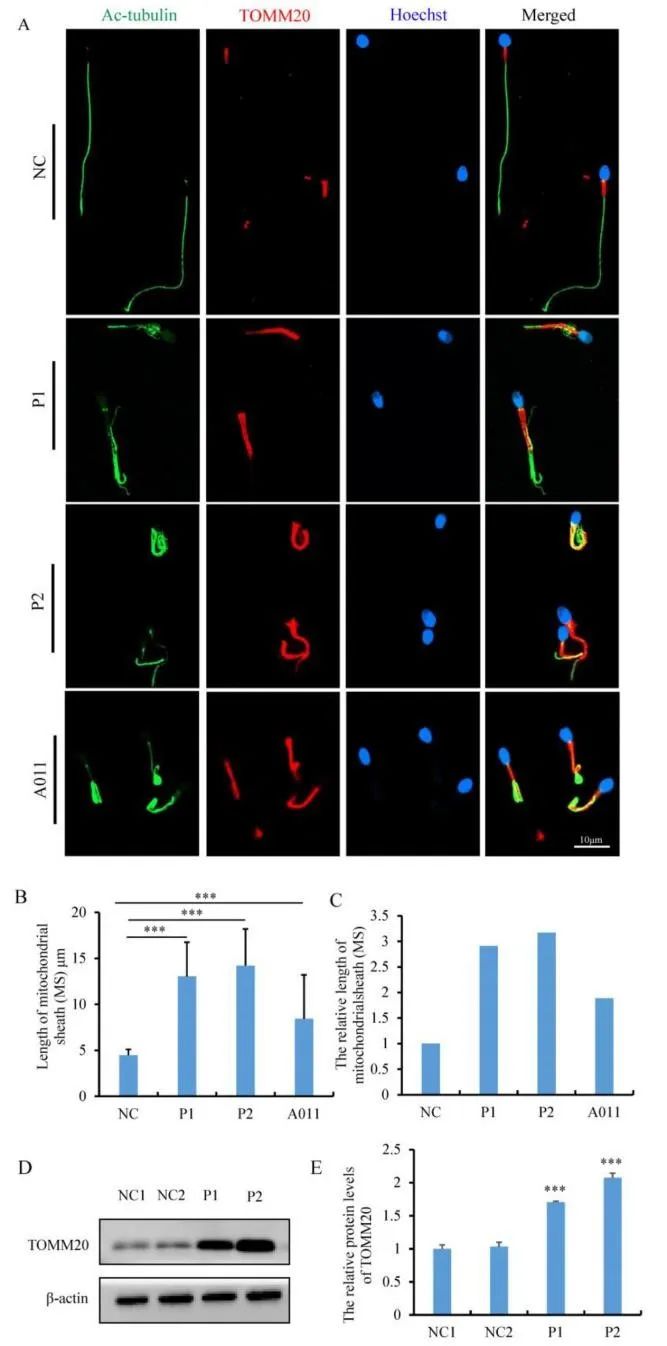
图4 患者组与对照组中线粒体鞘长度与TOMM20蛋白分析
接下来,研究者对变长的线粒体鞘的功能进行评估,立即(t=0)或1小时后(t=1)用伊红染色液化精子,然后分别检测精子活力。结果发现,与对照组相比,P2与A011精子活力更低,且一个小时后有更多的精子死亡,如图5A所示。有些出乎意料的是,通过检测ATP含量与消耗量发现,患者组精子的ATP含量远多于正常对照组。在37℃一个小时后,正常组消耗了50%的ATP,而P1和P2的ATP下降比例较少,如图5B所示。此外,通过流式细胞仪检测染色后的精子来分析线粒体膜电位(MMP)。如图5C和D所示,与对照组相比,患者精子中的MMPs略有减少。以上结果揭示了FSIP2缺陷会导致人类精子线粒体功能障碍。
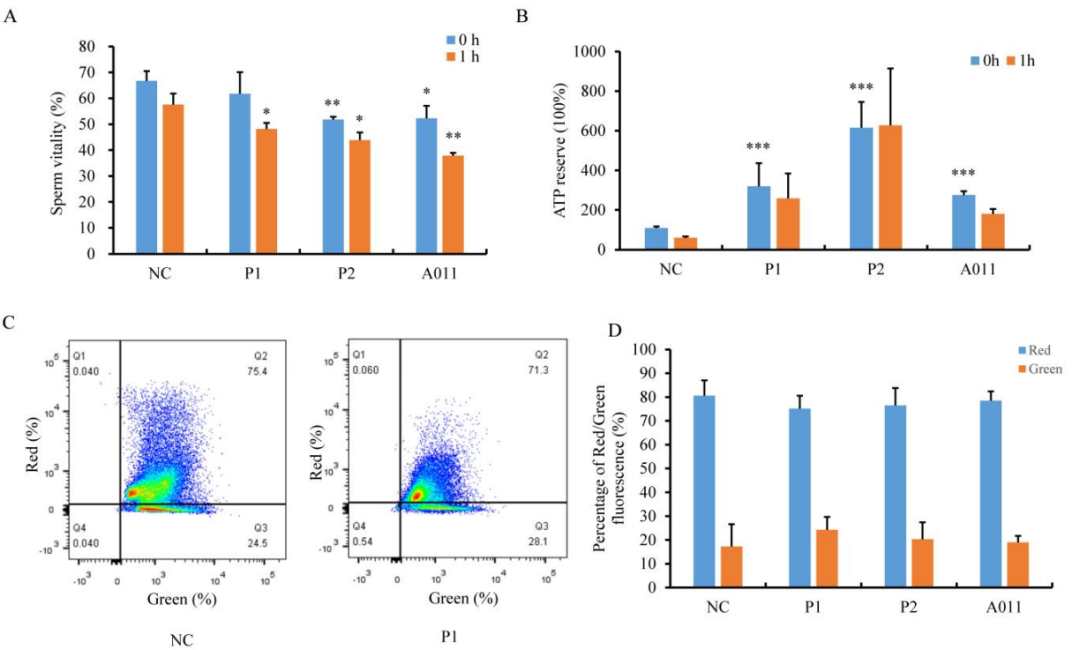
图5 患者组与对照组中线粒体功能的评估
为研究FSIP2变异影响精子线粒体鞘长度的潜在因素,研究者使用免疫荧光分析环蛋白SEPT4的含量和定位,SEPT4是分隔中段和主段的环形圈的关键组成。通过荧光显微镜,发现在正常精子中SEPT4点阵位于精子线粒体鞘的末端,如图6AⅠ所示。而患者组中,SEPT4的分布在大多数精子中显得杂乱无序,如图6A和B所示。另外,患者组中一半以上的精子存在鞭毛部位SEPT4信号的缺失,如图6C所示。
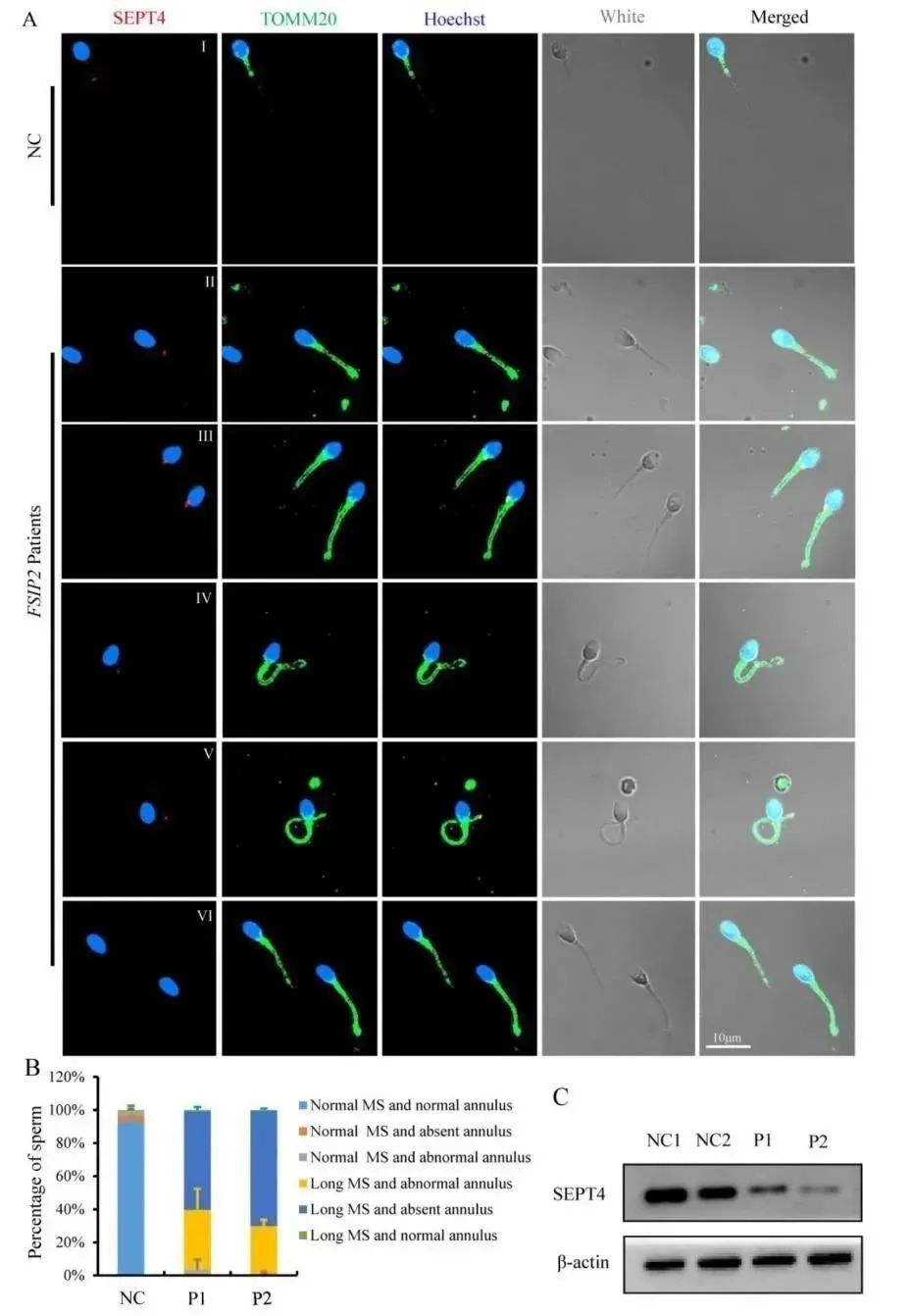
图6 患者组与对照组中免疫荧光染色分析SEPT4含量及定位
携带FSIP2变异的患者缺乏AKAP4蛋白并且改变了鞭毛轴丝和IFT-B复合物的分布
为探索患者精子主段中超微结构的缺陷,研究者测量了不同亚结构的纤维鞘和轴丝组成蛋白的定位和含量水平,包括SPAG6 (中央微管复合物的组成部分),AKAP4(定位于纤维鞘的蛋白)和DNAI2(动力蛋白轴突中间链2,外动力蛋白臂(ODA)的组成部分)。结果发现,在对照组精子中,SPAG6、AKAP4和DNAI2信号的分布是沿着精子鞭毛的,但这在患者组的精子中几乎不存在(图7A、B和D),这个结果同样通过WB检测得到了证实(图7D)。以上结果表明,FSIP2变异能够影响中央微管成分、纤维鞘和外动力蛋白臂(ODA)。
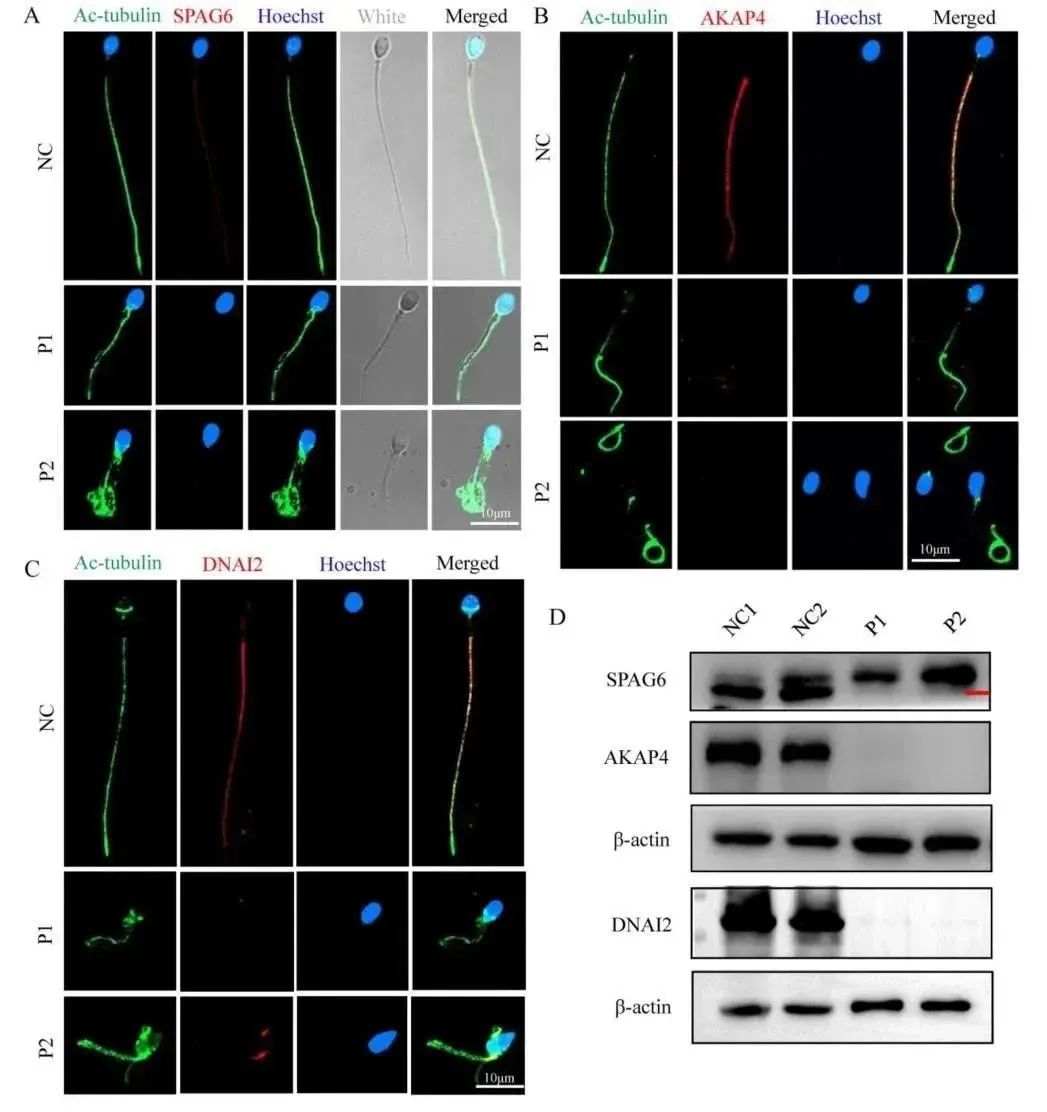
图7 患者组和正常组中鞭毛相关蛋白的含量和定位
IFT是一种高度保守的双向蛋白输送系统,能够运输纤毛/鞭毛相关蛋白,它至少包含22个高度保守的蛋白。研究者选取了其中的三种蛋白IFT88、IFT74、IFT20进行表达量和位置的检测,发现这三种蛋白的信号在P1中位置发生了改变,而在P2中几乎缺失,如图8A,B和C所示。蛋白质印迹分析发现,P1与对照组的三种蛋白水平含量差不多,而P2则出现了显著降低,如图8D所示。这种结果可能与不同截短蛋白的形成有关。总之,此次结果表明,FSIP2对鞭毛轴丝的正常组装是必须的,在鞭毛相关蛋白正常运输到组装位置中有着重要作用。
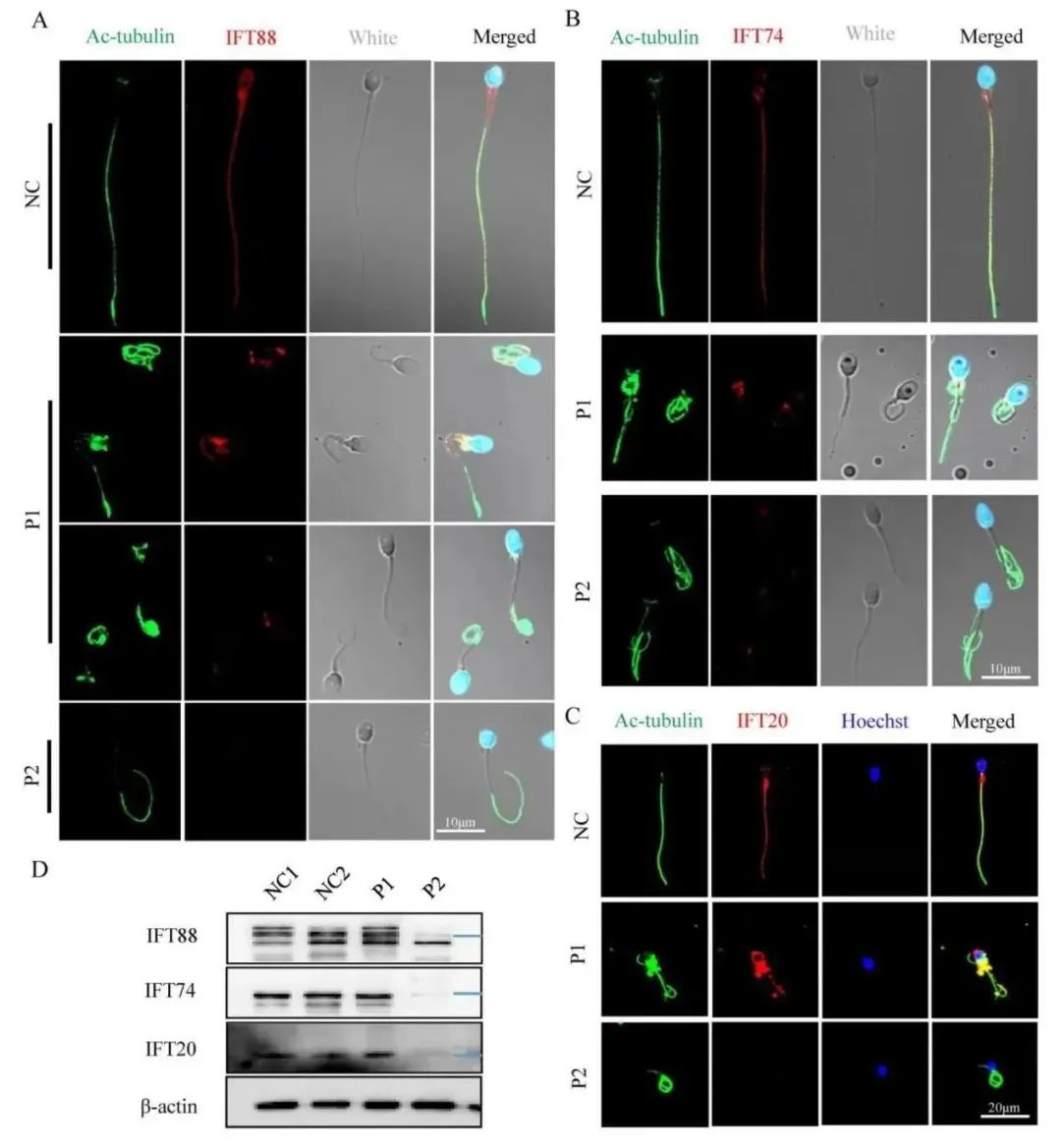
图8 患者组和正常组中IFT-B相关蛋白(IFT88、IFT74、IFT20)的含量和定位
通过ICSI治疗携带FSIP2基因变异的不育患者
携带FSIP2变异的3名患者不可能让配偶自然怀孕,研究表明ICSI可以帮助大多数弱畸形精子症患者克服自身的缺陷。此次研究中,P1和P2患者的配偶均通过ICSI成功妊娠,最后生育了健康的孩子。在2018年报道的A011夫妇也同样通过ICSI有了正常的后代。比较遗憾的是P3的后续治疗信息不得而知,这些患者的ICSI详情见表3。这3对夫妇的成功妊娠结局为携带FSIP2变异和类似变异的MMAF患者的临床治疗方案提供了指导,并为ICSI帮助特发性弱畸形精子症患者成功受孕提供了有力证据。
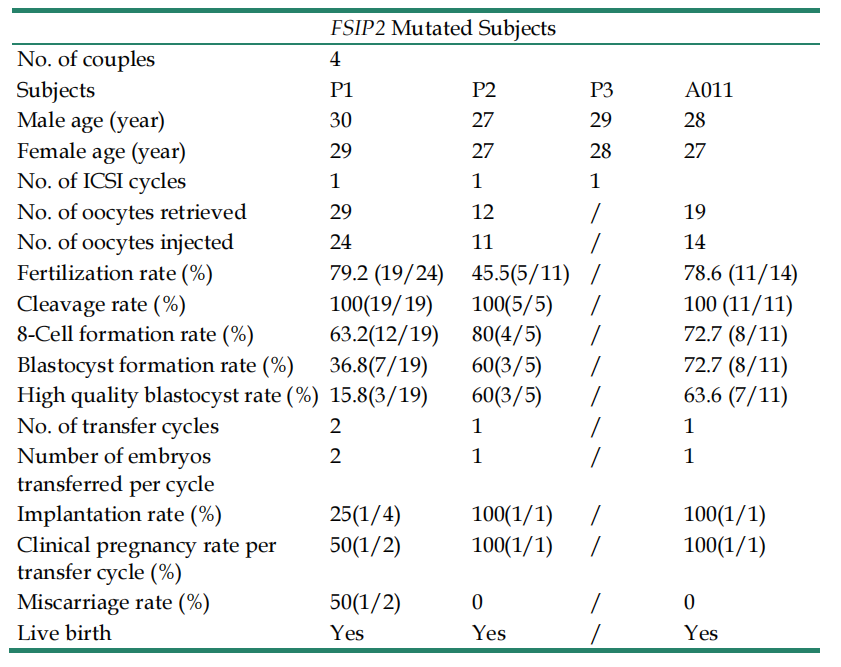
表3 4名患者的ICSI结局
总结
本次研究表明,FSIP2基因缺陷不仅引起纤维鞘的严重发育不良,还会导致纤毛轴丝的完全不稳定,从而引起MMAF表型。纤维鞘的极度紊乱和缺失导致精子环的丢失和“超长”的线粒体鞘。此外,对这些患者的女性伴侣进行ICSI治疗后,可以获得成功的妊娠结局。总体来说,该研究成果扩展了FSIP2基因变异谱,并获得了更多关于FSIP2 变异引起精子异常的信息。

