胎盘是最重要但最不为人知的器官之一。由于传统研究方法的局限性,人们对小鼠胎盘的研究还远远不够全面,特别是在早期发育阶段滋养层谱系的分化方面。
2023年3月17日,安徽医科大学国家卫生健康委配子及生殖道异常研究重点实验室蒋祥祥、中国科学院动物研究所王红梅及美国德克萨斯大学吕晓寅共同通讯在Cell Discovery(IF=38)在线发表题为“A differentiation roadmap of murine placentation at single-cell resolution”的研究论文,该研究揭示了单细胞分辨率下小鼠胎盘的分化路线图。为了破译细胞组成和发育过程,作者系统地分析了胎外组织和胎盘滋养层细胞的单细胞转录组。
在小鼠胎盘形成过程中鉴定出不同的滋养细胞类型,包括未报道的祖细胞和中间前体细胞。在系统转录组分析后,提出了小鼠滋养层谱系的最新分化路线图。基于转录组调控网络推理,作者确定了在谱系多样化过程中调控动态发育过程的转录因子。研究人员绘制了谱系分化轨迹,发现窦状滋养层巨细胞起源于胎盘外锥细胞亚群。该研究提供了一个全面的单细胞数据资源,以阐明未来调控血液膜胎盘的基因调节网络的机制研究。

胎盘是连接母亲和胎儿的复杂而有组织的辅助器官,保证物质的交换和激素的产生,以成功地维持妊娠。它也是一种强大的生理和免疫屏障,保护发育中的胎儿免受可能的宫内感染。胎盘畸形可引起许多胎盘缺陷相关疾病,如子痫前期和宫内胎儿生长受限。人和小鼠都表现出血膜胎盘,其特征是母体血管空间与胎儿滋养细胞直接接触。因此,小鼠模型已成为了解人类胎盘发育和妊娠并发症病因学的有力工具。最近的一项研究表明,相当大比例的表现出早期胚胎致命的突变小鼠系表现出严重的胎盘畸形,这强调了胎盘在胚胎发生过程中的重要作用。小鼠细胞系在囊胚期分离为内层细胞团(ICM)和外层营养外胚层(TE)。植入后不久,壁TE通过内复制分化为高度多倍体滋养层细胞,也称为原代顶叶滋养层巨细胞(primary P-TGCs)。相反,在胚胎极,极性TE在相邻ICM分泌的成纤维细胞生长因子4(Fgf4)的调节下保持其增殖能力。从E4.5到E6.5,未分化的极性TE形成胚胎外胚层(ExE)。极性TE和ExE都被认为是滋养细胞干细胞(TSCs)的来源。ExE的不断扩张产生了胎盘外锥(EPC)。原肠胚形成(E6.5-E8.5)后,形成EPC腔和绒毛膜腔(外体层)。连接区的滋养层细胞被认为起源于共同的EPC前体。然而,一些滋养层细胞类型的发育历史仍然不清楚,包括单核窦状TGCs (S-TGCs)和次级P-TGCs的起源。由于Ctsq只有在E12.5之后才能检测到表达,所以S-TGCs的前体还没有被确定。次级P-TGCs被认为来自Tpbpa +∕−SpT前体细胞或EPC细胞,但其确切的发育起源仍不清楚。
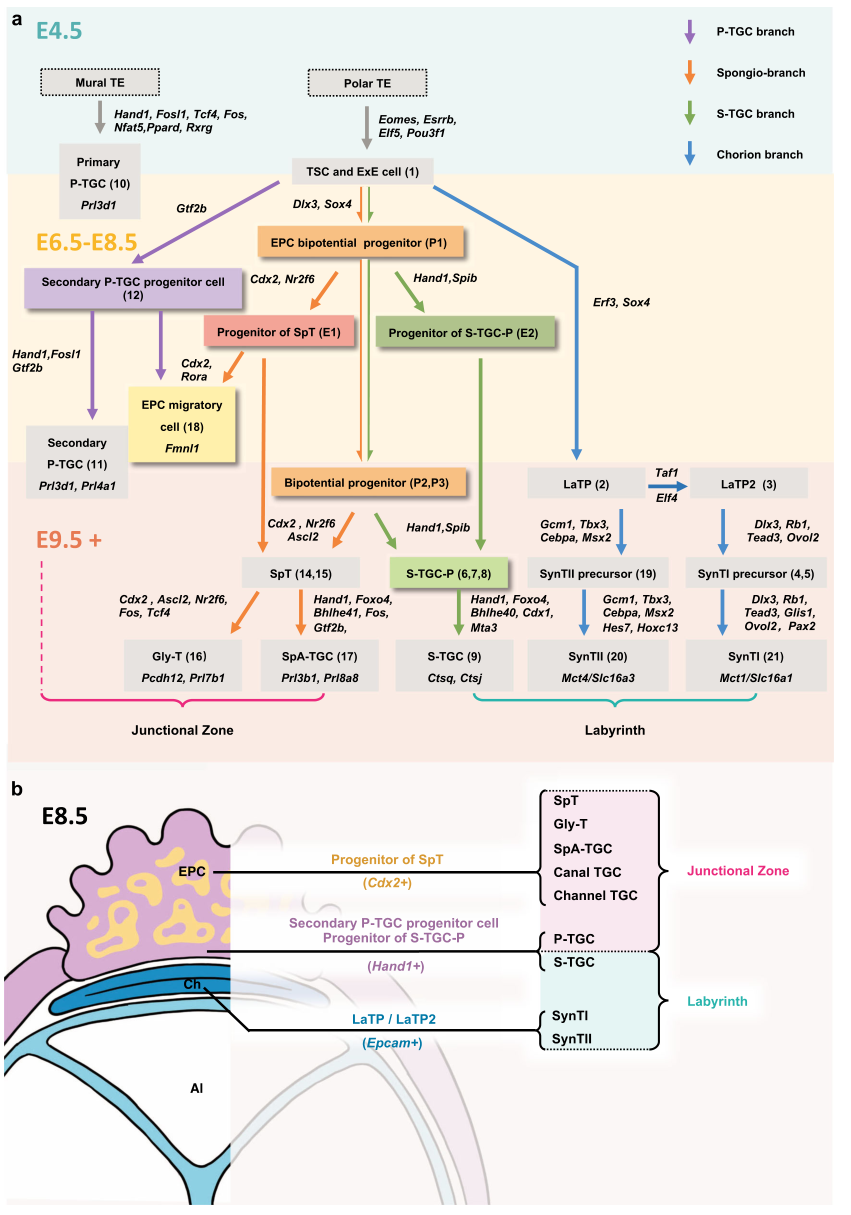
小鼠滋养层细胞谱系分化路线图的生物信息学证据(图源自Cell Discovery )
近几十年来,基于小鼠突变系的使用和原位标记实验,人们对小鼠滋养层谱系的发育起源和生理功能的认识显著增加。特别是,大量的转录因子(TFs)已被证明可以调节滋养层谱系分化。然而,已知参与滋养层谱系分化的有限调节网络不足以解释小鼠胎盘的发育过程。除了这些零碎的知识,仍缺乏从单细胞转录组学的角度对小鼠滋养层细胞发育调控的系统概述。该研究展示了小鼠滋养层谱系分化的高分辨率路线图,并确定了动态胎盘的调节分子,这可能为未来血液胎盘和妊娠维持的研究提供有价值的资源。中国科学院动物研究所王红梅研究员、美国MD Anderson癌症研究中心吕晓寅博士、安徽医科大学重点实验室蒋祥祥教授为论文共同通讯作者。安徽医科大学重点实验室蒋祥祥教授、中国科学院动物研究所博士研究生王越为论文共同第一作者。该研究得到科技部国家重点研发计划、国家自然科学基金委重点项目以及中国科学院重点部署项目的资助。
原文链接:https://www.nature.com/articles/s41421-022-00513-z
转载自iMedicines:https://mp.weixin.qq.com/s/N8UJcvnogbEvEoK5Q0pfWA

